Hablamos de un tumor maligno de color verde de las células mieloides.
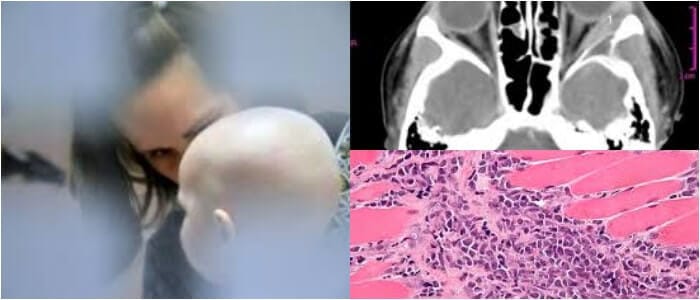
El cloroma es un tumor sólido compuesto por una proliferación extramedular similar a una masa de células primitivas del linaje mieloide que causa la eliminación de la arquitectura del tejido nativo.
El primer caso de cloroma fue observado por el médico británico Burns en 1811 en sus observaciones sobre la anatomía quirúrgica de la cabeza y el cuello.
Más tarde, en 1853, King acuñó el término «cloroma», ya que el tumor era frecuentemente de color verdoso debido a la presencia de la enzima mieloperoxidasa.
Sin embargo, se observó que hasta un tercio de estos tumores pueden ser blancos o grises. Por lo tanto, Rappaport propuso el término granulocítico que se prefiere y se usa de manera intercambiable con el cloroma.
Causas
El cloroma puede desarrollarse a cualquier edad. Sin embargo, casi el 60% de los casos se observan en niños menores de 15 años sin predilección específica por género. Es una manifestación rara de leucemia mieloide aguda (LMA) con una incidencia notificada de 2,5 a 9%.
En ocasiones, se puede observar en otras afecciones mieloproliferativas o mielodisplásicas, como metaplasia mieloide, policitemia vera, síndrome hipereosinofílico o trombocitosis esencial. Los informes de casos raros también sugieren su aparición en la leucemia linfoide.
La cronología de la aparición de cloroma en el trastorno mieloproliferativo o mielodisplásico es variable; en consecuencia, se pueden ver los siguientes patrones:
- Concurrente con la AML: más común, que se manifiesta en el momento de la presentación inicial o en cualquier momento durante la fase activa de la AML.
- Recaída: se presenta meses o años después en la remisión de la AML, especialmente en receptores de trasplante de médula ósea. El cloroma que se desarrolla durante la remisión se considera una enfermedad sistémica a pesar de los recuentos sanguíneos normales y los hallazgos de la médula ósea.
- Precursor de la transformación en fase blástica: en condiciones mieloproliferativas no leucémicas, anunciando la crisis blástica y la posterior transformación de la AML.
- Cloroma primario: una forma rara no leucémica, que se presenta en una población por lo demás sana en ausencia de anomalía de la médula. El cloroma primario precede a cualquier anomalía hematológica en casi el 35% de los casos. Generalmente sufre una transformación leucémica en meses o años, con un intervalo promedio de 10 meses.
Ciertos factores de riesgo que aumentan la probabilidad de desarrollar cloroma en la AML incluyen M4 o M5, marcadores de células T específicos que expresan mieloblastos CD13 y CD14, alto recuento total de leucocitos periféricos y ciertas anomalías cromosómicas t o inv.
Por el contrario, el cloroma en la recaída de AML puede deberse a ciertas peculiaridades biológicas de las células blásticas leucémicas, como la expresión molecular de marcadores responsables del aumento de la infiltración tisular (CD87) y la adhesión (CD56 y CD138).
La predilección frecuente de estas lesiones en ciertos sitios propugna la hipótesis de una respuesta subóptima a la quimioterapia o la respuesta de injerto contra leucemia.
Los sitios más comunes de cloroma son el hueso y el periostio, lo que se explica por la diseminación directa desde la médula infiltrada contigua.
Otros sitios frecuentemente involucrados son la piel (leucemia cutis), los ganglios linfáticos y la órbita, aunque cualquier sitio puede verse potencialmente afectado. El cloroma tiene una alta propensión a la recurrencia con una distribución espacial y temporal variable.
Síntomas del cloroma
En muchos casos, los sarcomas granulocíticos no causan síntomas importantes y aproximadamente el 50% de los casos de cloroma se diagnostican solo durante la autopsia.
Los síntomas del cloroma generalmente son causados por la masa en sí o por la forma en que afecta al órgano en el que se encuentra. El cloroma en el SNC se asocia con síntomas como el síndrome de cauda equina o radiculopatía.
Modalidades de diagnóstico
El cloroma generalmente permanece asintomático (aproximadamente 50%) o puede tener manifestaciones inespecíficas relacionadas con el efecto de masa, la disfunción de un órgano o el dolor en el sitio afectado.
La imagen transversal es indispensable para delinear los sitios y el grado de participación además de caracterizar estas lesiones.
El papel de la radiografía simple está restringido a la evaluación de las manifestaciones esqueléticas y la evaluación preliminar de las lesiones pulmonares u obstrucción intestinal.
La ecografía es conveniente para evaluar estructuras superficiales como la piel, los testículos o durante el seguimiento de las lesiones abdominales.
El cloroma es un tumor de tejidos blandos que puede ser circunscrito o infiltrado de manera difusa. Los hallazgos de la TC son variables, que en cierta medida dependen del sitio de participación.
Por lo general, las lesiones craneoespinales son hiperdensas en la TC sin contraste (NCCT) y muestran una intensificación homogénea intensa en la TC con contraste (CECT). Por el contrario, las lesiones en las vísceras y órbitas abdominales son frecuentemente hipodensas y mejoran levemente.
La RM es útil para la evaluación de la afectación craneoespinal y musculoesquelética, especialmente en casos indeterminados. En MRI, es iso / hipointenso en T 1 y ligeramente hiperintenso en T 2. La RM también es apta para el seguimiento de imágenes debido a la falta de problemas de radiación.
Imágenes nucleares tales como flúxiglucosa flúor-18 (18F-FDG) la tomografía por emisión de positrones (PET) / TC y el galio-67 son valiosos para evaluar la multiplicidad y la evaluación de la respuesta después de la quimioterapia.
En las exploraciones con 18 F-FDG-PET / CT y galio-67, el cloroma muestra una ávida captación. La 18 F-FDG-PET es imprescindible en la planificación de la radioterapia.
A pesar de todas estas modalidades de obtención de imágenes, los hallazgos en la ecografía, la TC, la RMN o la 18 F-FDG-PET siguen siendo genéricos, no se distinguen de otras neoplasias malignas y con frecuencia se confunden con linfoma, una neoplasia hematológica mucho más frecuente.
La confirmación diagnóstica del cloroma se establece esencialmente en la inmunohistoquímica (IHC) mediante la demostración de anticuerpos monoclonales contra ciertos antígenos de superficie específicos. Los marcadores más expresados son CD43, CD 68 y lisozima.
Según la clasificación de la Organización Mundial de la Salud (2008), las tinciones citoquímicas específicas para el diagnóstico de cloroma deben incluir cloroacetato esterasa, mieloperoxidasa y esterasa no específica.
Una horda de otros marcadores que pueden expresarse incluye CD4, CD33, CD34, CD56, CD117 o desoxinucleotidil transferasa terminal dependiendo del linaje y la maduración de las células mieloides.
Existe una alta probabilidad de diagnóstico erróneo en la patología, en tan alto como 47% de los casos por la falta de aplicación específica de marcadores IHC, si no se sospecha de cloración preventiva de cloroma en la imagen, especialmente en la forma no leucémica.
Tratamiento y pronóstico
Debido a su rareza, existe una disponibilidad limitada de datos para establecer la incidencia exacta del cloroma en el pronóstico de la leucemia u otras afecciones mieloproliferativas.
En la AML, el pronóstico permanece en gran parte sin cambios; sin embargo, los estudios sugieren refractariedad a la terapia y mayor probabilidad de recaída.
Por el contrario, el sarcoma mieloide primario o el cloroma en la remisión de la AML se clasifican como enfermedades sistémicas y se tratan en las líneas de la leucemia incluso con recuentos de leucocitos periféricos normales o médula ósea (BM).
De manera similar, el cloroma en varias otras afecciones mieloproliferativas y mielodisplásicas sugiere una transformación leucémica y justifica una quimioterapia anti leucémica sistémica.
El tratamiento localizado, como la cirugía o la radioterapia, es muy eficaz para aliviar los síntomas de compresión, especialmente en el cloroma espinal y puede proporcionar beneficios de supervivencia inmediata en algunos casos; sin embargo, la supervivencia general o el pronóstico no se ven afectados y están determinados por la enfermedad sistémica.
En promedio, la supervivencia media después del diagnóstico de cloroma es de 7,5 meses. El pronóstico no se ve afectado por la edad, el sexo o la condición mieloproliferativa / mielodisplásica subyacente.
En general, el pronóstico es independiente del sitio de participación; sin embargo, las lesiones en sitios poco comunes pueden resultar perjudiciales principalmente debido al retraso en el reconocimiento, aunque las lesiones pueden no ser necesariamente más agresivas que sus contrapartes en otros lugares.
Es probable que un aumento reciente en la incidencia de cloroma se deba a la longevidad prolongada de la leucemia como consecuencia de la disponibilidad de nuevas opciones de tratamiento (por ejemplo,trasplante alogénico de médula ósea, infusión repetida de linfocitos del donante, segundo trasplante).
Sin embargo, el diagnóstico de cloroma, especialmente la forma no leucémica, es bastante desafiante y es esencialmente un enfoque holístico que involucra hallazgos clínicos, de laboratorio y de imágenes.
Los radiólogos a menudo son los portadores estándar para llegar al diagnóstico al elevar su sospecha sobre las imágenes que guían al hematopatólogo para ejecutar la citometría de flujo, la IHC y la inmunofenotipificación en consecuencia.
Para el impacto en el pronóstico y la supervivencia general, los radiólogos deben ser conscientes de las posibles manifestaciones de la imagen, los sitios potenciales de participación, particularmente en neoplasias hematológicas conocidas, para alarmar su sospecha.
De esta forma se facilita el diagnóstico temprano que puede alterar el manejo y detener la progresión de la enfermedad. Pocas series también informaron una tasa menor de transformación leucémica si la EM primaria se reconoce y trata oportunamente.
A pesar de la participación agresiva y extensa, estas lesiones son muy sensibles a la quimioterapia de inducción; además, destacando la necesidad de reconocimiento oportuno.
Resumen
El cloroma se refiere a la proliferación extramedular de precursores mieloides inmaduros que ocurren en una gama de condiciones mieloproliferativas y mielodisplásicas; La leucemia mieloide aguda es la más frecuente.
Con manifestaciones clínicas y de imagen inespecíficas, corre un alto riesgo de diagnósticos erróneos que pueden afectar significativamente el resultado de una lesión que de otra manera se puede tratar. También con estas lesiones anunciando inminentes crisis de explosión, la conciencia de los hallazgos de la imagen se vuelve imperativa.
La toma de imágenes no solo ayuda a levantar la sospecha, sino que también guía una confirmación adicional mediante la demostración de marcadores inmunohistoquímicos específicos, lo que garantiza la institución oportuna de la quimioterapia.
En general, las lesiones sólidas que mejoran en cualquier trastorno hematológico podrían ser cloromas, especialmente si son multifocales con efecto de masa.