Son proteínas receptoras que se enlazan en la matriz extracelular con proteínas específicas y a otras proteínas en las células adyacentes.
Las integrinas son proteínas que funcionan mecánicamente, uniendo el citoesqueleto celular a la matriz extracelular y bioquímicamente, detectando si se ha producido una adhesión.
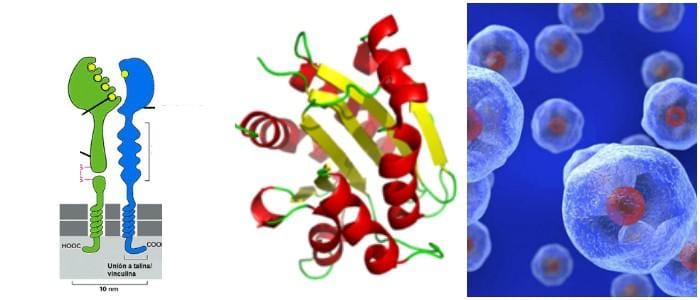
La familia de proteínas integrinas consiste en subtipos alfa y beta, que forman heterodímeros transmembrana.
Estructura de la integrina
Cada heterodímero de integrina consiste en una subunidad alfa (α) y beta (β) asociada a interacciones no covalentes.
Estas forman una cabeza de unión al ligando extracelular, dos «patas» multidominio, dos hélices transmembrana de paso simple y dos colas citoplásmicas cortas.
Los grupos α y β no muestran homología entre sí, sin embargo, las regiones conservadas se encuentran entre los subtipos de ambos grupos.
La pierna de la subunidad α consta de un muslo y 2 dominios de gemelos que soportan la cabeza de unión del ligando formada por un dominio de hélice β con 7 repeticiones que forman las cuchillas.
Algunos de los dominios de la pala de hélice contienen dominios EF de unión de calcio en el lado inferior; estos alostéricamente afectan el ligando vinculante.
Un dominio αI (interactivo) adicional que contiene aproximadamente 200 residuos está presente en algunas cadenas α de vertebrados (nueve subtipos α humanos) entre las repeticiones 2 y 3 de la hélice.
Este contiene un sitio de adhesión dependiente de iones metálicos que es importante para la unión del ligando.
La subunidad β comprende 4 repeticiones de factor de crecimiento epidérmico rico en cisteína, un dominio híbrido (dividido en secuencia), un dominio de tipo I (βI) y un dominio de plexina-sempahorina-integrina.
Similar a αI, el dominio βI contiene un sitio de adhesión dependiente de iones metálicos para unión al ligando y sitio regulador adicional adyacente al de adhesión dependiente de iones metálicos, inhibido por Ca2 + y activado por Mn2 + para la unión al ligando.
Unión del ligando
El dominio βI se une al ligando junto con la hélice β o con αI (si está presente) a través de sitio de adhesión dependiente de iones metálicos en una forma dependiente de Mg2 + en la interfaz en el casco.
Mientras que el grupo Asp carboxilo coordina el ion βI el sitio de adhesión dependiente de iones metálicos Mg2 +, el hidrógeno de la cadena lateral del Arg del ligando RGD se une directamente al Asp en los dominios 2 y 3 de la hélice β.
Dimerización
Son estructuras de dominio globular de subunidades α y β en un dímero estable. La unión del ligando ocurre en la interfaz del αI o la hélice β y el dominio βI.
La dimerización ocurre a través de la superficie de la hélice β en la cadena α y el dominio híbrido en la cadena β en el citoplasma.
Las secuencias en estas superficies que interactúan parecen controlar la especificidad de la selección de la cadena.
Se ha demostrado que los dímeros están estabilizados y permanecen inactivos por las interacciones hidrofóbicas y los puentes salinos electrostáticos en las regiones proximales de la membrana externa e interna, respectivamente.
Interacciones
Se sabe que la cola citoplásmica de la cadena β se une a los adaptadores de proteínas, esto activa las integrinas rompiendo el puente de sal entre el dímero.
En general, las proteínas adaptadoras promueven la unión a la actina, sin embargo, los filamentos intermedios también han sido implicados a través de la vimentina.
Función de las integrinas
Las integrinas contienen subunidades grandes (α) y pequeñas (β).
Algunas integrinas median el reconocimiento y las interacciones directas entre células.
Las integrinas contienen sitios de unión para cationes divalentes Mg 2+ y Ca 2+, que son necesarios para su función adhesiva.
Estas grandes familias de glucoproteínas transmembrana heterodiméricas, unen las células a las proteínas de la matriz extracelular de la membrana basal o a los ligandos de otras células.
Las integrinas poseen una función estructural y anclan la célula matriz u otra célula.
Las integrinas funcionan además de receptores de adhesión para los ligandos extracelulares, detectan señales bioquímicas en la célula, a través de proteínas efectoras.
Sorprendentemente, funcionan bidireccionalmente, lo que significa que pueden transmitir información tanto fuera como dentro de la célula.
Participan en la curación de heridas, en la migración celular y en la fagocitosis.
La integrina en los leucocitos es principalmente responsable de la adhesión de los linfocitos al endotelio vascular y al reclutamiento de leucocitos en el área inflamada.
Clasificación de las integrinas
Las diferencias existentes en la cadena beta de las integrinas permite dividirlas en tres categorías: la subfamilia β-1, formada por los antígenos VLA, la subfamilia β-2, formada por LFA-1, el receptor del complemento 3, y p150,95, y la subfamilia β-3, constituida por la glicoproteína IIb/IIIa y el receptor de la vitronectina.