Son cadenas de aminoácidos que poseen varias longitudes.
Un péptido contiene dos o más aminoácidos, y un polipéptido, por otro lado, contiene diez o más aminoácidos.
Los enlaces peptídicos mantienen unidos tanto péptidos como polipéptidos. Las células T en el cuerpo reconocen los péptidos y polipéptidos como proteínas muy pequeñas.
En algunos productos farmacéuticos se usan péptidos y polipéptidos en las vacunas para estimular la producción de anticuerpos.
Los bioquímicos generalmente usan el término polipéptido para describir cadenas peptídicas de tamaño mediano que consisten en 10 o más aminoácidos.
En bioquímica, el término proteína es inespecífico, porque incluye cadenas de aminoácidos de cualquier longitud.
Sin embargo, los polipéptidos se refieren a proteínas de un tamaño particular. Cuando se hace referencia al término polipéptido se describe a un tamaño general de cadenas peptídicas.
Por ejemplo, la hormona pancreática insulina es un ejemplo de un polipéptido. La función de la insulina es ayudar al cuerpo a usar y almacenar azúcar.
Estructura
Los polipolipeptidos funcionan como elementos estructurales del cuerpo. Algunos de ellos son componentes vitales de los músculos y los huesos.
Por ejemplo, los péptidos actina y miosina son componentes estructurales importantes de los músculos.
Los polipéptidos también contribuyen a la forma y a la resistencia de los huesos. Los huesos y los músculos no solo proporcionan estructura al cuerpo, sino que también participan en el movimiento y brindan protección a los órganos internos.
Los polipolipeptidos funcionan como elementos estructurales del cuerpo. Algunos de ellos son componentes vitales de los músculos y los huesos.
Los péptidos y polipéptidos son cadenas de aminoácidos y el sistema endocrino secreta péptidos y polipéptidos.
Después de que se secretan, la sangre se encarga de distribuir los péptidos y los polipéptidos a los órganos terminales como el corazón, los riñones y el hígado.
Los órganos endocrinos involucrados en este proceso de secreción incluyen la glándula tiroides, el hipotálamo, la glándula pituitaria, las glándulas suprarrenales, el páncreas endocrino, los tejidos adiposos y los ovarios.
El orden y la disposición de estos aminoácidos en una cadena de polipéptidos producirán diferentes estructuras químicas.
La estructura de una proteína es esencial para su función. Por lo tanto, se pueden unir varios aminoácidos para formar una cadena polipeptídica particular con una función específica.
Del mismo modo, las letras del alfabeto se pueden reorganizar para formar diferentes palabras, cada una con su propio significado.
En una imagen de una representación simple de una cadena de polipéptidos hecha de varios aminoácidos diferentes, cada patrón representa un aminoácido diferente.
Así podemos afirmar que una cadena de polipéptidos consiste en un montón de aminoácidos diferentes unidos entre sí.
Las cadenas de aminoácidos, están unidas por enlaces peptídicos. Cada extremo del polipéptido se denomina terminal amino o terminal N, que tiene un grupo amino libre.
El otro extremo del polipéptido tiene un grupo carboxilo libre llamado terminal C o terminal carboxilo. Los polipéptidos juegan un papel muy importante en las proteínas en las células.
Las proteínas consisten en una o más moléculas de polipéptidos. Las proteínas son importantes ya que ayudan a las células de varias maneras. De hecho, la mitad de la masa de la célula está compuesta de proteínas.
También es compatible con la estructura celular y almacena sustancias importantes, asi mismo controla las funciones metabólicas y mejora la respuesta inmune de las células.
Los polipéptidos producen proteínas al unir varios aminoácidos. Dos o más polipéptidos se unen y se pliegan en una forma específica para formar una proteína particular.
El otro nombre para polipéptido es un polímero de aminoácidos. Son cadenas de monómeros y subunidades unidas por un enlace químico.
Una cadena simple de un polipéptido se llama proteína simple, dos ejemplos de polipéptidos son la insulina y la hormona del crecimiento.
Niveles de estructura polipeptídica
Los polipéptidos tienen cuatro niveles de estructura y son los siguientes:
Estructura primaria
El nivel primario de estructura en una proteína es la secuencia más lineal de aminoácidos, formada por una reacción de condensación (y, por lo tanto, la extracción de agua) en la síntesis de proteínas.
Cada residuo de aminoácido se une a través de enlaces peptídicos. Otros enlaces covalentes también se incluyen en la estructura primaria, como los enlaces disulfuro.
El enlace peptídico tiene un carácter de doble enlace parcial y, por lo tanto, todos los átomos en el enlace peptídico se encuentran en el mismo plano rígido, llamado plano amida.
Esta restricción es importante para definir el plegamiento de una proteína en tres dimensiones.
La única rotación posible de la cadena principal es sobre el enlace alfa carbono-carbono (designado con la letra griega psi), y el enlace alfa carbono-nitrógeno (designado con la letra griega phi).
Por lo tanto, los planos de amida definen la cadena principal del polipéptido.
Estructura secundaria
El nivel secundario de estructura en una proteína es el plegamiento regular de las regiones de la cadena de polipéptidos. Los dos tipos más comunes son la hélice alfa y la hoja plisada beta.
- α-hélice: esta es una espiral derecha en la que cada enlace peptídico está en la conformación trans.
- Hoja plisada β: esta tiene una cadena de polipéptidos extendida con una cadena cercana que se extiende antiparalela entre sí. Cada hoja plegada β es trans y plana. Puede producirse un enlace de hidrógeno entre las cadenas de polipéptidos cercanas.
Se refiere a la disposición ordenada de aminoácidos en la ubicación localizada del polipéptido. El patrón de plegado se estabiliza con la ayuda de enlaces de hidrógeno.
Tanto la mioglobina como la hemoglobina están compuestas principalmente de hélices alfa.
En una barra como la alfa-hélice, los aminoácidos se organizan en una conformación helicoidal regular.
El oxígeno carbonílico de cada enlace peptídico está unido por hidrógeno al hidrógeno en el grupo amino del cuarto aminoácido alejado con los enlaces de hidrógeno que corren casi paralelos al eje de la hélice.
En una hélice alfa hay 3,6 aminoácidos por vuelta de la hélice que cubren una distancia de 0,54 nm, y cada residuo de aminoácido representa un avance de 0,15 nm a lo largo del eje de la hélice.
Las cadenas laterales de los aminoácidos están todas colocadas a lo largo del lado de la hélice cilíndrica.
Estructura terciaria
La estructura terciaria se refiere a la disposición espacial de los aminoácidos que están muy separados en la secuencia lineal, así como a los residuos adyacentes.
Nuevamente, es la secuencia de aminoácidos que determina la estructura tridimensional.
En las proteínas globulares solubles en agua, como la mioglobina, la principal fuerza impulsora detrás del plegamiento de la cadena de polipéptidos es el requisito energético de enterrar los aminoácidos no polares en el interior hidrofóbico lejos del medio acuoso circundante.
Una vez plegada, la molécula tridimensional, biológicamente activa (nativa) se mantiene no solo por interacciones hidrofóbicas, sino también por fuerzas electrostáticas, enlaces de hidrógeno y, si están presentes, enlaces disulfuro.
Estructura cuaternaria
Es un término utilizado para describir proteínas y consiste en múltiples moléculas de polipéptidos. Cada molécula de polipéptido se llama monómero.
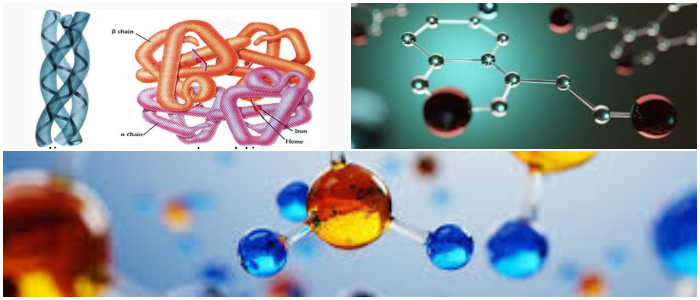
Las proteínas que contienen más de una cadena de polipéptidos, como la hemoglobina, exhiben un cuarto nivel de estructura proteica llamada estructura cuaternaria.
Este nivel de estructura se refiere a la disposición espacial de las subunidades polipeptídicas y la naturaleza de las interacciones entre ellas.
En el caso de la hemoglobina, las cuatro subunidades se mantienen unidas por fuerzas débiles de van der waals.
La hemoglobina tiene cuatro monómeros, que son dos cadenas α, cada una de las cuales contiene 141 aminoácidos y dos cadenas β, y cada una contiene 146 aminoácidos.
Funciones de los polipéptidos
Los polipéptidos tienen varias funciones importantes y su función depende de su tamaño y de la secuencia de aminoácidos.
Hay 20 aminoácidos naturales, y cada uno es un poco diferente uno de otro. Todos los aminoácidos tienen la misma estructura básica, sin embargo, algo llamado grupo R distingue un aminoácido de otro.
Los péptidos se encuentran en todas las células y tejidos del cuerpo y son una parte integral de la mayoría de los procesos biológicos. Es necesario mantener niveles adecuados de concentración y actividad de péptidos para lograr la homeostasis y mantener la salud en perfecto estado.
Los péptidos son moléculas más comúnmente conocidas como proteínas. Todos los péptidos están compuestos de aminoácidos unidos químicamente.
Los péptidos varían en tamaño desde dos aminoácidos, dipéptidos, hasta miles de aminoácidos o polipéptidos. La función de un péptido está determinada por su tamaño y secuencia de aminoácidos.
Los polipeptidos pueden funcionar como:
Transportistas
Todas las células tienen una membrana protectora que evita que la mayoría de las sustancias pasen fácilmente a la célula.
Algunos polipéptidos actúan como transportadores que permiten selectivamente que ciertas sustancias pasen a la célula a través de la membrana celular permeable.
Por ejemplo, los transportadores de glucosa son necesarios para que la glucosa viaje de la sangre hacia otras células.
La glucosa se traslada al músculo u alguna otra célula para que pueda ser utilizada como energía. Del mismo modo, los productos de desecho celular también pueden salir de la célula a través de ciertos transportadores de péptidos.
Enzimas
Las enzimas son catalizadores biológicos que aceleran las reacciones metabólicas del organismo.
La mayoría de las enzimas son polipéptidos. Cientos de enzimas se encuentran distribuidas en todo el cuerpo para acelerar las reacciones involucradas en muchos procesos.
Estos procesos incluyen la digestión de los alimentos, la producción de energía y la síntesis de los componentes celulares.
Hormonas
Las hormonas actúan como mensajeros biológicos que transportan información desde un tejido y se movilizan a través de la sangre hasta llevarlas a un tejido distante.
Dos clases comunes de hormonas son las hormonas peptídicas y los esteroides. Los ejemplos de hormonas peptídicas incluyen aquellos involucrados en la regulación de la glucosa en sangre, como la insulina y el glucagón, y aquellos que regulan el apetito, como la grelina y la leptina.