Es uno de los principales aminoácidos descubiertos y sintetizados mucho antes de su aislamiento de fuentes naturales.
En 1850, este aminoácido fue sintetizado por Adolph Strecker a partir de acetaldehído a través de su condensación utilizando amoníaco y cianuro de hidrógeno.
Solo en un cuarto de siglo, la alanina se descubrió en fuentes naturales como las proteínas.
Función
Es básicamente un aminoácido no esencial que a veces se encuentra en niveles elevados en su estado libre en el plasma humano.
En los mamíferos juega un papel clave en el ciclo de glucosa-alanina entre los tejidos y el hígado.
En los músculos y otros tejidos que degradan los aminoácidos como combustible, los grupos amino se recogen en forma de glutamato por transaminación.
El glutamato puede luego transferir su grupo amino a piruvato, un producto de la glucólisis muscular, a través de la acción de la alanina aminotransferasa, formando alanina y α-cetoglutarato.
La alanina ingresa al torrente sanguíneo y es transportada al hígado.
La reacción de la alanina aminotransferasa tiene lugar a la inversa en el hígado, donde el piruvato regenerado se usa en la gluconeogénesis, formando glucosa que retorna a los músculos a través del sistema de circulación.
El glutamato en el hígado entra en las mitocondrias y se descompone por la glutamato deshidrogenasa en α-cetoglutarato y amonio, que a su vez participa en el ciclo de la úrea para formar urea que se excreta a través de los riñones.
El ciclo de glucosa-alanina permite eliminar el piruvato y el glutamato del músculo y transportarlo de manera segura al hígado, donde la glucosa se regenera a partir del piruvato y luego se devuelve al músculo, esto mueve la carga energética de la gluconeogénesis al hígado en lugar del músculo, y todo el ATP disponible en el músculo se puede dedicar a la contracción muscular.
Es una vía catabólica, y se basa en la descomposición de proteínas en el tejido muscular. No está claro si esto es igual y/o en qué medida ocurre en los no mamíferos.
También es conocido por aumentar la inmunidad y proporcionar energía para el cerebro, el sistema nervioso central y para el tejido muscular.
En pocas palabras, la alanina ayuda a su cuerpo a convertir el azúcar simple llamado glucosa en la energía que necesita, al tiempo que elimina el exceso de toxinas de su hígado.
Como se conoce, los aminoácidos son los componentes básicos de las proteínas, convirtiéndose así en la clave para desarrollar músculos, y la alanina también está en la lista, lo que ayuda a proteger las células de daños durante la actividad física intensa.
Luego, debido al hecho de que el fluido en la glándula prostática contiene este aminoácido, se sugirió que la alanina podría ayudar a tratar la hiperplasia prostática benigna, que es la condición en la que se agranda la próstata.
Estructura
Es un aminoácido alifático, porque la cadena lateral conectada al átomo de carbono α es un grupo metilo (-CH3), por lo que es el α-aminoácido más simple a excepción de la glicina.
La cadena lateral de metilo de la alanina no es reactiva y, por lo tanto, casi nunca participa directamente en la función de la proteína.
Debido a que la cadena lateral de alanina no puede ser fosforilada (solo se conocen compuestos como 3-fosfino-L-alanina y 3-hidroxifosfinilalanina), es útil en experimentos de pérdida de función con respecto a la fosforilación.
Algunas técnicas implican la creación de una biblioteca de genes, cada uno de los cuales tiene una mutación puntual en una posición diferente en el área de interés, a veces incluso en todas las posiciones del gen completo, esto se denomina «mutagénesis de barrido».
El método más simple, y el primero que se usó, es el llamado «escaneo de alanina», donde cada posición a su vez está mutada a alanina.
Propiedades químicas
Estabilidad de radicales libres:
La desaminación de una molécula de alanina produce un radical libre de alquilo estable, CH3C • HCOO-. La desaminación puede ser inducida en alanina sólida o acuosa por radiación.
Esta propiedad de la alanina se usa en mediciones dosimétricas en radioterapia.
Cuando se irradia alanina normal, la radiación hace que ciertas moléculas de alanina se conviertan en radicales libres y, como estos radicales son estables, el contenido de radicales libres puede medirse más tarde mediante resonancia paramagnética de electrones con el fin de averiguar a cuánta radiación estuvo expuesta la alanina.
Se considera que esto es una medida biológicamente relevante de la cantidad de daño por radiación que sufriría el tejido vivo bajo la misma exposición a la radiación.
Los planes de tratamiento con radioterapia se pueden administrar en modo de prueba a gránulos de alanina, que luego se pueden medir para verificar que el sistema de tratamiento aplique la correcta dosis de radiación.
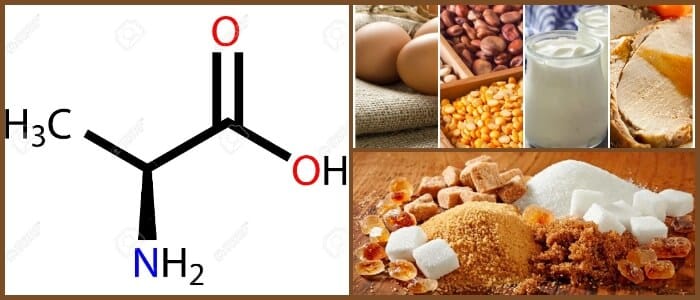
Fuentes de alanina
Alimentos:
Como se mencionó anteriormente, la alanina es un aminoácido no esencial, es decir, un cuerpo sano puede producirlo para sus propias necesidades.
Sin embargo, puede convertirse en un aminoácido esencial (lo que significa que necesitaría un suplemento dietético) si su cuerpo no puede fabricarlo por alguna razón.
Para evitar esta deficiencia, las personas con dietas bajas en proteínas o trastornos de la alimentación, así como aquellos que padecen enfermedades hepáticas o diabetes, pueden necesitar tomar suplementos de este aminoácido.
Para estar sano, el cuerpo humano requiere alanina para procesar la vitamina B.
Naturalmente, puede obtener este aminoácido de fuentes tales como carne, aves, huevos, productos lácteos y pescado.
A los vegetarianos se les recomienda comer alimentos vegetales ricos en proteínas, por ejemplo, aguacate, ya que también suministran alanina.
Biosíntesis:
La alanina se puede sintetizar a partir de piruvato y aminoácidos de cadena ramificada como valina, leucina e isoleucina.
La alanina se produce con mayor frecuencia mediante la aminación reductiva de piruvato, un proceso de dos pasos.
En el primer paso, α-cetoglutarato, amoníaco y NADH se convierten por la glutamato deshidrogenasa en glutamato, NAD + y agua.
En el segundo paso, el grupo amino del glutamato recién formado se transfiere a piruvato por una enzima aminotransferasa, regenerando el α-cetoglutarato y convirtiendo el piruvato en alanina.
El resultado neto es que el piruvato y el amoníaco se convierten en alanina, consumiendo un equivalente reductor.
Debido a que las reacciones de transaminación son fácilmente reversibles y el piruvato está presente en todas las células, la alanina se puede formar fácilmente y, por lo tanto, tiene vínculos estrechos con las vías metabólicas, como la glucólisis, la gluconeogénesis y el ciclo del ácido cítrico.
Síntesis química:
La alanina racémica se puede preparar mediante la condensación de acetaldehído con cloruro de amonio en presencia de cianuro sódico mediante la reacción de Strecker o mediante la amonólisis del ácido 2-bromopropanoico.
Degradación:
La alanina se descompone por desaminación oxidativa, la reacción inversa de la reacción de aminación reductiva descrita anteriormente, catalizada por las mismas enzimas.
La dirección del proceso está ampliamente controlada por la concentración relativa de los sustratos y productos de las reacciones involucradas.
Diabetes:
Las alteraciones en el ciclo de alanina que aumentan los niveles de alanina aminotransferasa (ALT) en suero están relacionadas con el desarrollo de diabetes tipo II.