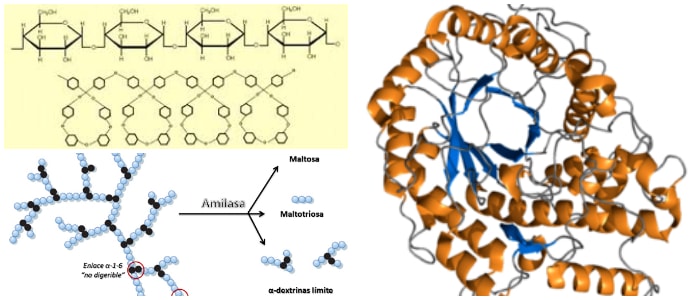
Es una enzima que cataliza la hidrólisis de almidón en azúcares.
La amilasa está presente en la saliva de los seres humanos y algunos otros mamíferos, donde comienza el proceso químico de la digestión.
Los alimentos que contienen grandes cantidades de almidón pero poca azúcar, como el arroz y las papas, pueden adquirir un sabor ligeramente dulce a medida que se mastican porque la amilasa degrada parte del almidón en azúcar.
El páncreas y la glándula salival producen amilasa (alfa amilasa) para hidrolizar el almidón dietético en disacáridos y trisacáridos que otras enzimas convierten en glucosa para suministrar energía al cuerpo.
Las plantas y algunas bacterias también producen amilasa. Como diastasa, la amilasa fue la primera enzima descubierta y aislada (por Anselme Payen en 1833).
Las proteínas específicas de la amilasa se designan con diferentes letras griegas. Todas las amilasas son glucósido hidrolasas y actúan sobre enlaces α-1,4- glicosídicos.
Las α-amilasas son metaloenzimas de calcio. Al actuar en ubicaciones aleatorias a lo largo de la cadena del almidón, la α-amilasa descompone los carbohidratos de cadena larga, produciendo finalmente maltotriosa y maltosa de la amilosa, o maltosa, glucosa y «límite de dextrina» de la amilopectina.
Debido a que puede actuar en cualquier parte del sustrato, la α-amilasa tiende a ser de acción más rápida que la β-amilasa. En animales, es una enzima digestiva importante, y su pH óptimo es 6.7-7.0.
En la fisiología humana, tanto la amilasa salival como la pancreática son α-amilasas.
La forma de α-amilasas también se encuentra en plantas, hongos (ascomicetos y basidiomicetos) y bacterias (Bacillus).
Otra forma de amilasa, β-amilasa también es sintetizada por bacterias, hongos y plantas. Trabajando desde el extremo no reductor, la β-amilasa cataliza la hidrólisis del segundo enlace glicosídico α-1,4, separando dos unidades de glucosa (maltosa) a la vez.
Durante la maduración de la fruta, la β-amilasa rompe el almidón en maltosa, dando como resultado el sabor dulce de la fruta madura.
Tanto la α-amilasa como la β-amilasa están presentes en las semillas; La β-amilasa está presente en una forma inactiva antes de la germinación, mientras que la α-amilasa y las proteasas aparecen una vez que ha comenzado la germinación.
Muchos microbios también producen amilasa para degradar los almidones extracelulares.
Los tejidos animales no contienen β-amilasa, aunque puede estar presente en microorganismos contenidos en el tracto digestivo. El pH óptimo para la β-amilasa es 4.0-5.0.
Usos
Fermentación
Las alfa y beta amilasas son importantes en la elaboración de cerveza y licor a partir de azúcares derivados del almidón.
En la fermentación, la levadura ingiere azúcares y excreta alcohol. En la cerveza y algunos licores, los azúcares presentes al comienzo de la fermentación se han producido granos u otras fuentes de almidón (como las papas).
En la elaboración de cerveza tradicional, la cebada malteada se mezcla con agua caliente para crear un «puré», que se mantiene a una temperatura determinada para permitir que las amilasas en el grano malteado conviertan el almidón de cebada en azúcares.
Distintas temperaturas optimizan la actividad de alfa o beta amilasa, dando como resultado diferentes mezclas de azúcares fermentables y no fermentables.
Al seleccionar la temperatura del macerado y la relación entre el grano y el agua, un cervecero puede cambiar el contenido de alcohol, la sensación en la boca, el aroma y el sabor de la cerveza terminada.
En algunos métodos históricos de producción de bebidas alcohólicas, la conversión del almidón en azúcar comienza cuando la cervecera mastica el grano para mezclarlo con la saliva. Esta práctica ya no se usa ampliamente.
Aditivo de harina
Las amilasas se utilizan en la panificación y para descomponer azúcares complejos, como el almidón (que se encuentra en la harina), en azúcares simples.
La levadura se alimenta de estos azúcares simples y los convierte en los productos de desecho de alcohol y CO 2. Esto imparte sabor y hace que el pan se eleve.
Mientras que las amilasas se encuentran naturalmente en las células de levadura, lleva tiempo que la levadura produzca suficientes de estas enzimas para descomponer cantidades significativas de almidón en el pan. Esta es la razón de las masas fermentadas largas como la masa agria.
Las técnicas modernas de panificación han incluido las amilasas (a menudo en forma de cebada malteada) en el mejorador de pan, lo que hace que el proceso sea más rápido y más práctico para uso comercial.
La alfa amilasa a menudo se menciona como un ingrediente en la harina molturada comercialmente. Los panaderos con exposición prolongada a la harina enriquecida con amilasa corren el riesgo de desarrollar dermatitis o asma.
Biología molecular
En biología molecular, la presencia de amilasa puede servir como un método adicional de selección para la integración exitosa de una construcción indicadora además de resistencia a antibióticos.
Como los genes informadores están flanqueados por regiones homólogas del gen estructural para la amilasa, la integración exitosa alterará el gen de la amilasa y evitará la degradación del almidón, que es fácilmente detectable mediante la tinción con yodo.
Usos médicos
La amilasa también tiene aplicaciones médicas en el uso de la terapia de reemplazo de enzimas pancreáticas. Es uno de los componentes en Sollpura (Liprotamase) para ayudar en la descomposición de carbohidratos en azúcares simples.
Otros usos
Un inhibidor de la alfa-amilasa, llamado faseolamina, se ha probado como una posible ayuda dietética.
Cuando se usa como aditivo alimentario, la amilasa tiene el número E E1100, y puede derivarse del páncreas de cerdo u hongo del moho.
La amilasa bacteriana también se usa en detergentes para ropa y lavavajillas para disolver almidones de telas y platos.
Los trabajadores de fábrica que trabajan con amilasa para cualquiera de los usos anteriores tienen un mayor riesgo de asma ocupacional.
Del 5 al 9% por ciento de los panaderos tienen una prueba cutánea positiva, y de un cuarto a un tercio de panaderos con problemas respiratorios son hipersensibles a la amilasa.
Hiperamilasemia
La amilasa en suero sanguíneo se puede medir para fines de diagnóstico médico.
Una concentración superior a la normal puede reflejar una de varias afecciones médicas, incluida la inflamación aguda del páncreas (puede medirse al mismo tiempo que la lipasa más específica), pero también úlcera péptica perforada, torsión de un quiste ovárico, estrangulación, íleo, isquemia mesentérica, macroamilasemia y paperas.
La amilasa se puede medir en otros líquidos corporales, incluida la orina y el líquido peritoneal.
Un estudio de enero de 2007 de la Universidad de Washington en St. Louis sugiere que las pruebas de saliva de la enzima podría usarse para indicar los déficits de sueño, ya que la enzima aumenta su actividad en correlación con el tiempo que un sujeto ha estado privado de sueño.
Evolución humana
Los carbohidratos son una fuente de alimentos rica en energía. Después de la revolución agrícola de hace 12,000 años, la dieta humana comenzó a cambiar más a la domesticación de plantas y animales en lugar de la caza y la recolección.
Los polímeros grandes tales como el almidón se hidrolizan parcialmente en la boca por la enzima amilasa antes de escindirse más en azúcares.
Por lo tanto, los seres humanos que contienen amilasa en la saliva se beneficiarían de una mayor capacidad para digerir el almidón de manera más eficiente y en mayores cantidades.
A pesar de los obvios beneficios, los primeros humanos no poseían amilasa salival, una tendencia que también se observa en los parientes evolutivos del ser humano, como los chimpancés y los bonobos, que poseen una o ninguna copia del gen responsable de producir la amilasa salival.
Este gen, AMY1, se originó en el páncreas.
Un evento de duplicación del gen AMY1 permitió que evolucionara la especificidad salival, conduciendo a la producción de amilasa en la saliva.
Además, el mismo evento ocurrió independientemente en roedores, enfatizando la importancia de la amilasa salival en organismos que consumen cantidades relativamente grandes de almidón.
Sin embargo, no todos los humanos poseen la misma cantidad de copias del gen AMY1. Las poblaciones que se sabe que dependen más de los carbohidratos tienen un mayor número de copias AMY1 que las poblaciones humanas que, en comparación, consumen poco almidón.
El número de copias de genes AMY1 en humanos puede variar desde seis copias en grupos agrícolas como europeo-americano y japonés (dos poblaciones con alto contenido de almidón) hasta solo 2-3 copias en sociedades de cazadores-recolectores tales como Biaka, Datog y Yakuts.
La correlación que existe entre el consumo de almidón y el número de copias de AMY1 específicas para la población sugiere que se seleccionaron más copias de AMY1 en poblaciones con alto contenido de almidón por selección natural y se consideró el fenotipo favorable para esos individuos.
Por lo tanto, lo más probable es que el beneficio de que un individuo posea más copias de AMY1 en una población con alto contenido de almidón aumente la aptitud física y produzca una descendencia más sana y en forma.
Este hecho es especialmente evidente cuando se comparan poblaciones geográficamente cercanas con diferentes hábitos alimenticios que poseen un número diferente de copias del gen AMY1.
Tal es el caso de algunas poblaciones asiáticas que se ha demostrado que poseen pocas copias AMY1 en relación con cierta población agrícola en Asia.