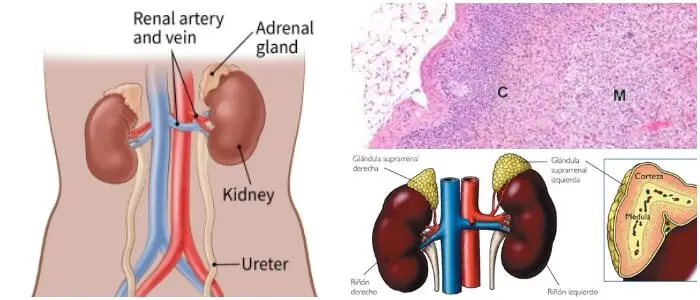
Ubicadas en la parte superior de cada riñón, son responsables de liberar diferentes clases de hormonas.
La parte externa de la glándula, llamada corteza suprarrenal, produce las hormonas cortisol y aldosterona. La parte interna de la glándula, llamada médula suprarrenal, produce las hormonas adrenalina y noradrenalina.
Corteza Suprarrenal
La corteza suprarrenal, la parte externa de la glándula, produce hormonas que son vitales para la vida, como el cortisol (que ayuda a regular el metabolismo y ayuda al cuerpo a responder al estrés) y la aldosterona (que ayuda a controlar la presión arterial).
Anatomía Suprarrenal
La corteza suprarrenal comprende tres zonas: la zona glomerular, fascicular y reticular.
La aldosterona, el mineralocorticoide bioactivo más importante en los seres humanos, se sintetiza en la zona más externa de la glomerular.
Esta región de la corteza suprarrenal está regulada por la circulación de sodio, potasio y angiotensina. La zona fascicular y reticular, producen tanto cortisol como corticosterona. Estas regiones de la suprarrenal, y en mucha menor medida de la zona glomerular, están reguladas por la ACTH liberada de la pituitaria anterior.
Hormonas de la corteza suprarrenal
El cortisol y sus análogos sintéticos han tenido un amplio uso clínico para el tratamiento de una variedad de trastornos durante más de 50 años.
Desde su primera aplicación clínica, la investigación intensiva ha ampliado nuestra comprensión de la fisiología, la bioquímica y la farmacología de los esteroides y ha llevado a una gran cantidad de literatura que aborda el uso terapéutico y los efectos secundarios dañinos de los corticosteroides.
Este capítulo revisa la farmacología y fisiología de los corticosteroides, discute el uso de estos agentes hormonales en el tratamiento de las neoplasias y presenta el mecanismo de acción actualmente conocido de los corticosteroides en el contexto de su eficacia terapéutica.
Ya a mediados del siglo XIX, se observó que la falta de glándulas suprarrenales funcionales es incompatible con la vida. La investigación posterior clasificó los efectos de la insuficiencia suprarrenal en dos grupos distintos: los debidos al desequilibrio electrolítico y los debidos a alteraciones. metabolismo de los carbohidratos.
El síndrome hipercortical fue descrito por Cushing en 1932 y en los años 1940 y 1950, la hormona adrenocorticotrópica (ACTH) se identificó en la parte anterior de la hipófisis y se describió como un estimulador de la corteza suprarrenal.
Durante este tiempo, varios esteroides bioactivos, incluyendo cortisol y aldosterona (los principales corticosteroides activos en humanos) se aislaron de la corteza suprarrenal y se caracterizaron.
En 1949, Hench informó por primera vez sobre la eficacia del cortisol y la ACTH en el tratamiento de la artritis reumatoide, una observación que se extendió rápidamente a aplicaciones terapéuticas en una amplia variedad de enfermedades.
La intensa investigación de estos compuestos se vio estimulada por este amplio interés clínico, y en la década siguiente, la mayor parte de la bioquímica involucrada en la síntesis y el metabolismo de los esteroides adrenocorticales fue dilucidada.
Durante este período, el campo de la terapia con corticosteroides avanzó rápidamente ya que la mayoría de los análogos de corticosteroides sintéticos disponibles en la actualidad se desarrollaron y se identificaron métodos prácticos de determinación de cortisol en plasma.
En los años intermedios, se desarrollaron análogos de corticosteroides sintéticos que separan los efectos del equilibrio antiinflamatorio y electrolítico.
Sin embargo, a pesar del esfuerzo continuo, no se ha logrado la separación exitosa de la eficacia clínica de los efectos secundarios nocivos.
En consecuencia, el uso crónico de estas poderosas drogas está limitado por su perfil lento y acumulativo de efectos secundarios. El daño asociado con la terapia con corticosteroides puede no ser aparente hasta que las consecuencias sean catastróficas.
Esteroides
Cinco clases de hormonas esteroides se producen en la corteza suprarrenal: glucocorticoides, mineralocorticoides, progestinas, andrógenos y estrógenos.
Sin embargo, la cantidad de progestina, andrógeno y estrógeno producida por la glándula suprarrenal es una fracción menor de la cantidad total de estos esteroides producidos en el cuerpo.
Por el contrario, los glucocorticoides y mineralocorticoides se producen casi exclusivamente en la corteza suprarrenal.
Los glucocorticoides tienen un amplio papel fisiológico que incluye tanto la regulación de las vías metabólicas de la glucosa como la modulación del sistema inmune. Los mineralocorticoides son reguladores clave del balance hídrico y mineral.
Caminos Biosintéticos
La biosíntesis de corticosteroides se ha caracterizado bien. El colesterol, el precursor de todas las rutas biosintéticas esteroideas, se convierte en una variedad de moléculas de esteroides en una serie de reacciones catalizadas por varias enzimas del citocromo P450 (cyp 450).
Mientras que se puede sintetizar algo de colesterol en la corteza suprarrenal, la gran mayoría del colesterol utilizado en la biosíntesis de esteroides se toma de un conjunto de colesterol circulante unido a lipoproteínas de baja densidad en el plasma.
Después de la síntesis, los corticosteroides se secretan rápidamente. Debido a que los corticosteroides no se almacenan en la corteza suprarrenal, la tasa de síntesis de esteroides es esencialmente igual a la tasa de secreción de la glándula suprarrenal.