Es la hemoglobina con grupo hemo con hierro en estado férrico, Fe(III) (es decir, oxidado).
Comúnmente se reconocen cuatro especies diferentes de hemoglobina: oxihemoglobina, desoxihemoglobina, metahemoglobina y hemicromos.
La metahemoglobina es un estado alterado de la hemoglobina creada en presencia de un estrés oxidante.
Este proceso ocurre naturalmente en el cuerpo a niveles bajos, y existen sistemas endógenos para reducir el estado férrico del hierro al estado ferroso.
Este estado anormal de hemoglobina o cambio en el resto de hierro altera su capacidad para unirse y liberar oxígeno y estos efectos conducen a hipoxia tisular y anemia funcional.
Esto hace que la hemoglobina sea incapaz de transportar oxígeno, lo que lleva a una disminución del suministro de oxígeno a los tejidos.
Efectos
Cuando se produce una elevación anormal en el nivel de metahemoglobina y excede la capacidad del cuerpo del proceso de reducción de metahemoglobina, se produce una metahemoglobinemia clínicamente significativa.
La metahemoglobinemia grave no tratada puede provocar graves síntomas hipóxicos y la muerte.
Debe sospecharse la metahemoglobinemia en un paciente cianótico sin una causa cardiovascular aparente.
Grupo hemo
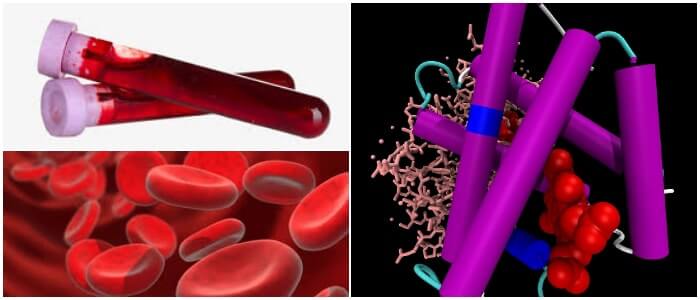
El grupo hemo consiste en un ion hierro, que está rodeado por un anillo de porfirina heterocíclica.
El centro de hierro tiene 6 sitios potenciales de coordinación, cuatro de los cuales están ocupados por nitrógenos de porfirina.
El quinto sitio de coordinación (debajo del plano del anillo) se une covalentemente con un residuo de histidina desde la posición F8 de su respectiva cadena de globina.
El sexto sitio de coordinación (sobre el plano del anillo) es donde ocurre toda la «acción».
Este es el lugar donde el oxígeno y otras moléculas pequeñas se unen transitoriamente al átomo de hierro, afectando su estructura electrónica y sus propiedades magnéticas.
Hemoglobina
Los eritrocitos son rojos debido a la presencia de hemoglobina, la macromolécula conglomerada responsable del transporte de oxígeno.
La función principal de la proteína hemoglobina contenida en los glóbulos rojos es el transporte de oxígeno en el aire inspirado de los pulmones a las células de los tejidos.
La molécula de hemoglobina adulta está compuesta por cuatro subunidades o cadenas polipeptídicas plegadas (dos alfa y dos beta), cada una de las cuales consta de un grupo hemo no proteico rodeado por una proteína enrollada (globina).
En el centro de cada uno de los cuatro grupos hemo se encuentra un átomo de hierro en el estado ferroso (Fe 2+).
Estos cuatro átomos de hierro son los centros funcionales de la molécula de hemoglobina porque es aquí donde el oxígeno se une de manera reversible para formar oxihemoglobina.
Cuando el oxígeno se descarga de la oxihemoglobina en los tejidos, el electrón compartido temporalmente es recapturado por el átomo de hierro, volviendo a su estado ferroso (Fe 2+).
Cualquiera que sea el detalle preciso de la unión del oxígeno a la hemoglobina, está claro que para que se produzca la unión, los átomos de hierro presentes en cada uno de los cuatro grupos hemo deben estar en estado ferroso.
Mecanismos fisiológicos para la conversión de hemoglobina a metahemoglobina
El efecto de la oxidación mediada por los radicales libres no se limita a la molécula de hemoglobina, muchas especies moleculares en las células de todo el cuerpo se ven afectadas.
Si no se controlan, estos cambios moleculares oxidativos pueden afectar la función y, en última instancia, causar la ruptura de la célula y lesiones.
La conversión del hierro del estado ferroso al férrico representa la pérdida de un electrón, es decir, es un proceso oxidativo.
Los glóbulos rojos y su contenido (incluida la hemoglobina) se consideran particularmente susceptibles a este estrés oxidativo debido a la concentración relativamente alta de oxígeno presente y la producción resultante de radicales libres de oxígeno.
En este estado químico de la hemoglobina el hierro desoxigenado del estado divalente (Fe 2+) del hemo, pierden un electrón y se oxidan para formar la forma trivalente de hemoglobina los hierros ferrosos (Fe 3+).
Los hierros de la metahemoglobina son incapaces de unirse reversiblemente al oxígeno. Además, la afinidad por el oxígeno del hierro de cualquier globina restante en el tetrámero de hemoglobina aumenta.
Así la formación de metahemoglobina a partir de la hemoglobina dentro de los glóbulos rojos es un proceso oxidativo en curso que resulta de la exposición de la hemoglobina a una variedad de moléculas altamente reactivas (radicales libres de oxígeno), producidas durante el metabolismo celular normal.
La única diferencia entre la hemoglobina y la metahemoglobina es que uno o más de los cuatro átomos de hierro en la molécula de metahemoglobina están en el estado férrico (Fe 3+) en lugar del ferroso (Fe 2+) y, por lo tanto, son incapaces de unirse al oxígeno.
La metahemoglobina también se forma durante la descarga de oxígeno de la desoxihemoglobina en los tejidos si, como sucede a veces, el electrón donado temporalmente no es recapturado por el átomo de hierro, este proceso se llama auto-oxidación.
Se ha estimado que alrededor del 3% de la hemoglobina se convierte a la metahemoglobina diariamente por estos dos mecanismos oxidativos.
Mecanismos fisiológicos para la conversión de metahemoglobina a hemoglobina
Afortunadamente, en vista de la amenaza potencial para el suministro de oxígeno que plantea la metahemoglobina, existen mecanismos de protección que aseguran que la mayor parte de esta metahemoglobina se vuelva a convertir en hemoglobina.
Los mecanismos de protección aseguran que la cantidad de metahemoglobina en la sangre no constituya normalmente más del 1 al 2% de la hemoglobina total.
Para que la metahemoglobina se convierta en hemoglobina de hierro en el estado férrico (Fe 3+) en cualquiera o en todos los cuatro grupos hemo, deben reducirse al estado ferroso (Fe 2+); en otras palabras, deben ganar un electrón.
Debido a la carga y descarga de oxígeno de la hemoglobina y las interacciones de los agentes oxidantes, el cuerpo tiene un bajo nivel de metahemoglobina que se reduce espontáneamente a la hemoglobina ferrosa (Fe 2+) a través de la acción de la reductasa de metahemoglobina y el donante de electrones del dinucleótido de nicotinamida y adenina.
El sistema comprende tres elementos: dinucleótido de nicotinamida y adenina, la proteína que contiene hemo, el citocromo b5, y la enzima, citocromo b5 reductasa. El donante de electrones es el dinucleótido de nicotinamida y adenina, un producto de la oxidación de la glucosa (glucólisis).
En condiciones fisiológicas, este sistema representa cerca del 99% de la reducción diaria de metahemoglobina a hemoglobina.
Cuando se exponen a una gran cantidad de un agente oxidante, estos sistemas endógenos se ven superados y el resultado es una concentración elevada de metahemoglobina (metahemoglobinemia adquirida).
La vía reductora, que depende de la enzima NADPH-MHb reductasa, también es capaz de convertir la metahemoglobina en hemoglobina, pero en condiciones fisiológicas normales esto es de muy poca importancia.
Sin embargo, esta vía alternativa es significativa en los casos de deficiencia de citocromo-b5-reductasa y es esencial para la acción terapéutica del azul de metileno, el fármaco utilizado para tratar la metahemoglobinemia adquirida.
Finalmente, varias especies de antioxidantes generales, es decir, donadores de electrones, presentes en los glóbulos rojos, como la reducción de glutatión y ácido ascórbico, pueden desempeñar un papel menor en la reducción de la metahemoglobina a la hemoglobina.