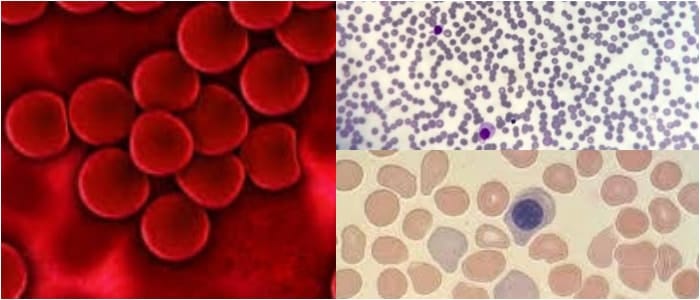
Se refiere a un grupo de anemias que tienen en común una reducción selectiva en la tasa de síntesis de ácido desoxirribonucleico (ADN).
Sin embargo, la transcripción, la traducción y la síntesis de proteínas proceden normalmente.
En consecuencia, se produce un crecimiento celular desequilibrado resultante y la dicotomía entre las tasas de maduración citoplásmica y nuclear se ensancha con cada división durante la eritropoyesis.
Hasta que finalmente la célula muere u omite la división terminal haciéndola sobrevivir como células de etapa final sobredimensionadas (macrocitos) con un acortamiento esperanza de vida.
Por lo tanto, la síntesis de ADN retardada conduce a la acumulación de megaloblastos muertos y moribundos en la médula, creando una apariencia falsa de hiperplasia medular pero con una reducción gradual en el número de células maduras que se expulsan y eventualmente progresan a pancitopenia.
Las anemias megaloblásticas son causadas por la deficiencia de vitamina B12, la deficiencia de folato o por afecciones relacionadas que causaron la alteración de la síntesis de ADN.
Epidemiología
Los estudios epidemiológicos sobre la anemia megaloblástica son escasos. Sin embargo, la frecuencia de la megaloblastosis es más alta en los países en los que la malnutrición es endémica y no se dispone de suplementos vitamínicos de rutina para las personas mayores y las mujeres embarazadas.
Las preparaciones defectuosas de alimentos y el aumento de la demanda de ácido fólico durante el embarazo son las causas más comunes de anemia megaloblástica.
Aproximadamente 1 de cada 7500 personas desarrollan anemia perniciosa en los EE. UU. Por año, pero esto ha sido modificado por la fortificación actual de alimentos y suplementos vitamínicos en pacientes de edad avanzada en los EE. UU.
Las estadísticas internacionales mostraron que la anemia perniciosa y la deficiencia de folato usualmente ocurren en individuos mayores de 40 años y la prevalencia aumenta con las poblaciones de mayor edad.
Se informa que la incidencia de la anemia perniciosa es más alta en Suecia, Dinamarca y el Reino Unido que en otros países desarrollados.
Fisiología de la cobalamina (B12) y el folato
La vitamina B12 consiste en un anillo de corrina con un átomo de cobalto en su centro unido a una porción de nucleótido y se denominan cobalaminas.
Las preparaciones farmacológicas biológicamente inactivas de vitamina B12 incluyen cianocobalamina e hidroxocobalamina, mientras que adenosilcobalamina y metilcobalamina que se generan mediante síntesis enzimática son las formas biológicamente activas.
Mientras que la adenosilcobalamina es la forma de tejido de la vitamina B12, la metilcobalamina circula en la sangre. Aunque una dieta normal proporciona un gran exceso de vitamina B12, el requerimiento diario es de aproximadamente 1-2 μg en adultos.
En el proceso de digestión, la proteína R, ya sea de origen salival o parietal, se une a la cobalamina liberada a partir de proteína dietética compleja a través de la acción de la secreción gástrica compuesta por pepsina y ácido clorhídrico.
El complejo de proteína cobalamina-R es secreciones pancreáticas degradadas en el duodeno para liberar cobalamina libre que luego se une al factor intrínseco que se secretó en el estómago.
El complejo de factor intrínseco de cobalamina se transporta ahora al íleon terminal donde tiene lugar la absorción. El fracaso de la actividad fisiológica en cualquiera de estos puntos produce anemia megaloblástica.
Después de la absorción, la vitamina liberada se une a una proteína de transporte llamada transcobalamina (TCII), que transporta la vitamina a la circulación enterohepática. La vitamina B12 se almacena principalmente en el hígado en una cantidad de 2-3 mg, que es 1000 veces superior al requerimiento diario.
El papel fisiológico de la vitamina B12 incluye:
- Conversión de metil-malonil-coenzima A (CoA) a succinil CoA por adenosil cobalamina.
- Conversión de homocisteína en metionina.
- Síntesis de S-adenosil-metionina.
Fisiología del folato
El ácido fólico es una molécula compuesta que consiste en pteridina, ácido p-amino benzoico y ácido glutámico.
Los folatos están disponibles como poliglutamatos en muchos alimentos, como las verduras de hoja verde, la levadura y el hígado. Sin embargo, la sobrecocción destruye fácilmente el ácido fólico. El folato se absorbe como monoglutamatos en el yeyuno superior.
El requerimiento diario de folato es de 150 μg y las reservas corporales de folato son suficientes durante 6 meses.
Los principales compuestos intracelulares son los poliglutamatos de folato con glutamatos adicionales unidos. Los folatos son esenciales en muchas reacciones bioquímicas, como la síntesis de purinas, timina y ácido desoxirribonucleico (ADN).
Causas principales de déficit de vitamina B12 o Cobalamina
Dietética: la causa dietética de la deficiencia de cobalamina es rara, excepto en vegetarianos estrictos que evitan tomar carne, huevos y productos lácteos.
Problemas con la absorción de cobalamina: la gastritis atrófica y la aclorhidria, que comúnmente ocurren en personas mayores, son las dos condiciones que son responsables de la liberación alterada de cobalaminas unidas a los alimentos. Por lo tanto, la cobalamina no se libera de los alimentos para el proceso de absorción.
Además, la destrucción autoinmune de las células parietales gástricas puede conducir a la falla de la producción del factor intrínseco.
Esta condición se llama anemia perniciosa. La anemia perniciosa se reconoce como la causa más conocida de la deficiencia de cobalamina. Se diagnostica en el 1% de las personas mayores de 60 años y la incidencia es ligeramente mayor en las mujeres que en los hombres.
La inhibición de la producción del factor intrínseco también puede ser causada por antagonistas H2.
La liberación de cobalamina de las proteínas R también puede ser inhibida por el ambiente alcalino en el intestino delgado que emana de la insuficiencia pancreática.
Por el contrario, el ambiente ácido visto en condiciones como el síndrome de Zollinger Ellison, también evita la unión de la cobalamina al factor intrínseco, lo que conduce a una disminución de la unión al factor intrínseco y a la interferencia final con la absorción de la cobalamina.
Los trastornos del íleon terminal, el sitio de captación del complejo del factor intrínseco de la cobalamina, pueden causar deficiencia de cobalamina.
Los trastornos que posiblemente pueden afectar el íleon terminal incluyen esprúe tropical, enfermedad inflamatoria intestinal, linfoma, así como resección ileal.
La destrucción autoinmune del receptor ileal, cubilina, como se encuentra en el síndrome de Imerslund Grasbeck, igualmente disocia la captación de cobalamina ligada al factor intrínseco.
Además, la colonización bacteriana puede ocurrir en intestinos deformados por estenosis, asas ciegas quirúrgicas, esclerodermia, enfermedad inflamatoria del intestino o síndrome de asa ciega de amiloidosis que puede dar como resultado la deficiencia de cobalamina.
En esta condición, las bacterias compiten con el huésped por la cobalamina para la absorción de cobalamina unida al factor intrínseco.
La tenia de los peces, como la infestación de Diphyllobothrium latum, que es común en lugares como Canadá, Alaska y el mar Báltico, se alimenta de cobalamina en el intestino, lo que reduce la cantidad de cobalamina disponible para la ingestión por el huésped.
Exposición al óxido nitroso
Las causas diversas de la deficiencia de cobalamina incluyen la exposición al óxido nitroso, que a través de la inactivación oxidativa de la cobalamina causa megaloblastosis.
La exposición prolongada al óxido nitroso puede provocar trastornos mentales y neurológicos graves.
Varios medicamentos como análogos de purina (seis mercaptopurina, seis tioguanina), análogos de pirimidina (cinco fluorouracilo y cinco azacitidina) y medicamentos que afectan el metabolismo de la cobalamina como el ácido P-aminosalicílico, la fenformina y la metformina que pueden causar deficiencia de cobalamina.
Deficiencia de folato y causas
La causa principal de la pérdida de folato de los alimentos es la mala preparación de los alimentos debido a una dilución excesiva de los alimentos en el agua, a un calentamiento excesivo y a la posterior inactivación del folato, ya que el folato es termolábil.
Sin embargo, la fortificación de los alimentos con folato y otras vitaminas está eludiendo este problema en los países desarrollados. Esto debe ser promovido agresivamente en muchos países en desarrollo.
El almacenamiento de folato dura aproximadamente 4 semanas, después de lo cual se produce una deficiencia de folato si se detiene la ingesta de folato. El requerimiento diario para adultos es de aproximadamente 0.4 mg / día.
La deficiencia de folato se produce en situaciones en las que existe una alteración de la absorción debido a ciertos trastornos intestinales como el esprúe tropical, el esprúe no tropical (enfermedad celíaca), la amiloidosis y la enfermedad inflamatoria intestinal.
La deficiencia de folato se produce en situaciones en las que existe un aumento de la demanda fisiológica de ácido fólico como estados hemolíticos crónicos como la anemia de células falciformes, esferocitosis hereditaria y eliptocitosis; embarazo, lactancia, crecimiento rápido, hiperalimentación.
También diálisis renal, donde hay una pérdida escalada de células que se dividen rápidamente como la psoriasis y la dermatitis exfoliativa.
Además, los medicamentos como la fenitoína, la metformina, la fenobarbitona, la dihidrofolato reductasa, los inhibidores de folato como el trimetoprim y la pirimetamina, el metotrexato y las sulfonamidas pueden causar deficiencia de folato.
Los cambios megaloblásticos en la infección por el virus de la inmunodeficiencia humana (VIH) y los trastornos mielodisplásicos se deben al efecto directo sobre el ácido desoxirribonucleico (ADN) en las células hemopoyéticas y otras que se dividen rápidamente.
Fisiopatología de la anemia megaloblástica
Las dos vitaminas, es decir, ácido fólico y cobalamina actúan sinérgicamente en la generación del ácido timidílico utilizado para la síntesis de ADN. Por lo tanto, en la deficiencia de cobalamina, el paro megaloblástico es en realidad causado por un déficit en la utilización de folato.
La metionina se genera mediante la transferencia de grupo metileno de N5-metiltetrahidrofolato (FH4) a homocisteína utilizando la enzima metil transferasa (metionina sintasa).
En este proceso bioquímico, la metilcobalamina es el factor que ayuda a la transferencia de metilo como forma de coenzima de la cobalamina. Esta es la razón por la cual las anormalidades morfológicas que emanan de la deficiencia de cobalamina o folato parecen exactamente iguales.
Síntomas
Las anemias megaloblásticas, independientemente de la causa, comparten ciertas características generales. La anemia se desarrolla lentamente con pocos o ningún síntoma hasta que el hematocrito está gravemente deprimido y en este punto, aparecen síntomas como:
- Debilidad.
- Palpitaciones.
- Fatiga.
- Mareos.
- Dificultad para respirar.
- La palidez severa y la ictericia leve se combinan para producir una piel reveladora de color amarillo limón.
Deficiencia de Folato o de vitamina B12
Se producen ligeras diferencias en los síntomas clínicos y en los signos de la anemia megaloblástica en función de si es causada por la deficiencia de folato o por la deficiencia de vitamina B12.
En la deficiencia de folato, las características clínicas principales incluyen:
- Síndrome anémico.
- Palidez.
- Ictericia.
- Síndrome del cazador.
- Pigmentación de las uñas.
- Cambio del color del cabello (canas temprano).
- Esplenomegalia en aproximadamente 10-15% de los pacientes.
Además de las características mencionadas, la deficiencia de cobalamina se manifiesta con síntomas neurológicos, que incluyen:
- Pérdida del sentido de la posición articular en los dedos del pie.
- Pérdida del sentido de la vibración en los dedos y dedos.
- Parestesia.
- Hipoestesia.
- Sensación de hormigueo.
- Anomalías en la marcha.
- Pérdida de coordinación.
- Debilidad muscular.
- Espasticidad.
- Neuropatía óptica.
- Incontinencia urinaria y fecal.
- Disfunción eréctil.
- Demencia.
- Pérdida de memoria.
Estas neuropatías son simétricas y solo afectan a las extremidades inferiores. Los signos demostrables incluyen el signo de Romberg positivo, reflejo Babinsky, signo de los termitos, espasticidad, hiporreflexia y clonus.
Características del laboratorio
Las características de laboratorio de la anemia megaloblástica giran en torno a las investigaciones de laboratorio y los hallazgos de deficiencias de vitamina B12 y ácido fólico.
Serum vitamin b12 y folato
Se sabe que estas pruebas están limitadas por su baja sensibilidad y especificidad, y se ha demostrado que los límites inferiores normales para los niveles de vitamina B12 no están bien definidos. Además, estas pruebas son costosas y no siempre están disponibles para el clínico en ejercicio.
Niveles de suero b12
Estudios previos mostraron que los niveles de vitamina B12 se encontraron normales o elevados en trastornos mieloproliferativos, enfermedad hepática, deficiencia congénita de transcobalamina II, sobrecrecimiento bacteriano intestinal y administración previa de vitamina B12.
Niveles de folato sérico
La deficiencia de ácido fólico es rara cuando la fortificación de alimentos está a la orden del día, como en los EE. UU.
Aunque los depósitos de tejido pueden ser normales, los niveles de folato sérico pueden disminuir a los pocos días de la restricción de folato en la dieta. Por lo tanto, los pacientes deben ayunar antes de analizar los niveles séricos de folato, ya que los niveles séricos de folato aumentan con la alimentación.
El grado leve de hemólisis puede mostrar falsamente niveles elevados de folato sérico debido a la alta concentración de folato dentro de los glóbulos rojos (GR).
Celula sanguinea roja (rbc) folato
En RBC (por sus siglas en ingles), el nivel de folato se considera como una fuente más confiable para determinar las reservas de folatos en los tejidos.
A diferencia del folato sérico, que se ve afectado por la ingesta dietética, los niveles de folato se mantienen constantes a lo largo de la vida de la célula.
Sin embargo, los ensayos para medir los niveles de folato en los glóbulos rojos también han estado llenos de falta de fiabilidad. Se ha establecido que la deficiencia de vitamina B12 es la causa de los bajos niveles de folato de glóbulos rojos.
Se estima que aproximadamente el 60% de los pacientes con anemia perniciosa tienen bajos niveles de folato en glóbulos rojos, presumiblemente porque la vitamina B12 es necesaria para la transferencia normal de metil tetrahidrofolato del plasma a glóbulos rojos.
Examen de la médula ósea
La médula aspirada a menudo es hipercelular con un notable desequilibrio en la maduración nuclear-citoplásmica a menudo denominada asincronía nuclear-citoplásmica.
Esta asincronía se produce debido a la síntesis progresiva deficiente del ADN y los trastornos nucleares que se acumulan con cada división celular, lo que ralentiza la replicación nuclear y causa retraso acumulativo en cada paso de la división de la maduración.
Por lo tanto, el desequilibrio en el crecimiento celular se vuelve más evidente en las células hematopoyéticas maduras.
Los sideroblastos, precursores de glóbulos rojos que contienen un mayor número de gránulos de hierro, se incrementan en proporción.
Además, debido a la hiperplasia eritroide, la proporción de precursores mieloides a eritroides (relación M / E) se invierte y puede caer a 1: 1 o incluso más bajo.
En casos severos, numerosos pronormoblastos gigantes que tienen un número inusualmente grande de figuras mitóticas están presentes.
El contenido de hierro de macrófagos a menudo se incrementa. Incluso con el intento de enmascarar la anemia megaloblástica por la coexistencia de anemia microcítica, una anemia megaloblástica generalmente mostrará neutrófilos hipersegmentados en la sangre y metamielocitos gigantes y bandas en la médula.
Se produce una desintegración sustancial de los eritroblastos dentro de la secuela de los senos medulares como consecuencia de una detención indebida prolongada de los eritroblastos con núcleos no condensados en los que los productos de su desintegración son escamafragma por los macrófagos.
Este proceso se conoce como eritropoyesis ineficaz.
Error de dignóstico
Cabe señalar que una anemia megaloblástica puede diagnosticarse erróneamente como leucemia aguda cuando la anemia megaloblástica es muy grave.
En este caso, los megaloblastos típicos están obviamente ausentes, y la mayoría de las células disponibles son pronormoblastos megaloblásticos extraños que dominan la médula debido a la falta de maduración de la serie eritroide y, por lo tanto, aumentan la posibilidad de eritroleucemia.
Por el contrario, un paciente con solo macrocitosis, sin anemia y sin ninguna anomalía celular en la película de sangre periférica puede no requerir un examen de médula ósea.
Los granulocitos y megacariocitos se ven igualmente afectados por el desequilibrio del crecimiento celular en la anemia megaloblástica.
Las células mieloides generalmente son de gran tamaño, pero es la presencia de metamielocitos gigantes y formas de unión gigantes que son realmente patognomónicas de la anemia megaloblástica.
También hay hipersegmentación lobular compleja (pseudo hiperdiploidia) de megacariocitos. Puede haber fragmentos de megacariocitos y plaquetas gigantes en circulación.
Concentraciones séricas de ácido metilmalónico (MMA) y homocisteina
Varias vías metabólicas importantes requieren las funciones de cobalamina y folato como cofactores. La generación de metionina a partir de la homocisteína requiere los cofactores de vitamina B12 y ácido fólico.
Sin embargo, la producción de succinil CoA a partir de l-metilmalonil CoA requiere solo vitamina B12. El succinil CoA generado está involucrado en reacciones de fosforilación oxidativa dentro de las células.
Por lo tanto, estos metabolitos proporcionan información temprana sobre el estado celular de la vitamina B12 y el folato.
Los niveles séricos de estos metabolitos son útiles para distinguir el folato de la deficiencia de vitamina B12, mientras que la mayoría de los pacientes con deficiencia de folato solo tienen niveles normales de ácido metilmalónico (MMA) o levemente elevados, pacientes con deficiencia de vitamina B12 nivel.
Es digno de mención que casi el 50% de los pacientes con elevación de estos metabolitos tienen niveles séricos de vitamina B12 normales. Por lo tanto, se enfatiza la baja sensibilidad de los niveles séricos de vitamina B12, especialmente cuando hay signos y síntomas implicantes.
En general, la medición de los niveles séricos de MMA y homocisteína es una forma bien establecida de diferenciar la deficiencia de cobalamina de la deficiencia de folato, mientras que en la deficiencia de cobalamina, ambos metabolitos están elevados.
Los pacientes con deficiencia de nonanemia cobalamina se identifican mejor usando MMA, que es mucho más sensible que la homocisteína, mientras que en pacientes con deficiencia de folato hay una marcada elevación de los niveles de homocisteína, mientras que los niveles séricos de MMA no son elevados.
Por lo tanto, la medición del nivel sérico de estos dos metabolitos proporciona un medio para distinguir la cobalamina de la deficiencia de folato y también proporciona un grado confiable de precisión en el diagnóstico de estos estados de deficiencia.
Sin embargo, la sensibilidad de identificar pacientes con deficiencia de cobalamina está enmascarada por una disfunción renal que conduce a una MMA sérica falsamente elevada.
También, hiperhomocisteinemia hereditaria, donde la homocisteína elevada puede causar confusión al diagnosticar la deficiencia de folato. Se recomienda que la medición de MMA se realice solo si los niveles iniciales de vitamina B12 u homocisteína son anormales.
Tratamiento
Sera determinado por el médico en base a:
- Edad, salud general e historial médico.
- Extensión de la afección.
- Causas de la anemia.
- La tolerancia a fármacos específicos.
- Las expectativas del tratamiento.
- La opinión o preferencia del paciente o representante.
Si el trastorno es causado por problemas digestivos (absorción de nutrientes), podría necesitar tratamiento. Suplementos de vitamina B12 son mejor absorbidos al ser inyectados.
Alimentos ricos en folato incluyen:
- Lechuga.
- Espinaca.
- Hígado.
- Arroz.
- Garbanzos.
- Coles.
- Germen de trigo.
- Frijoles de soya.
- Frijoles.
- Maní.
- Naranjas.
- Espárragos.
- Guisantes.
- Vegetales de hojas verdes.